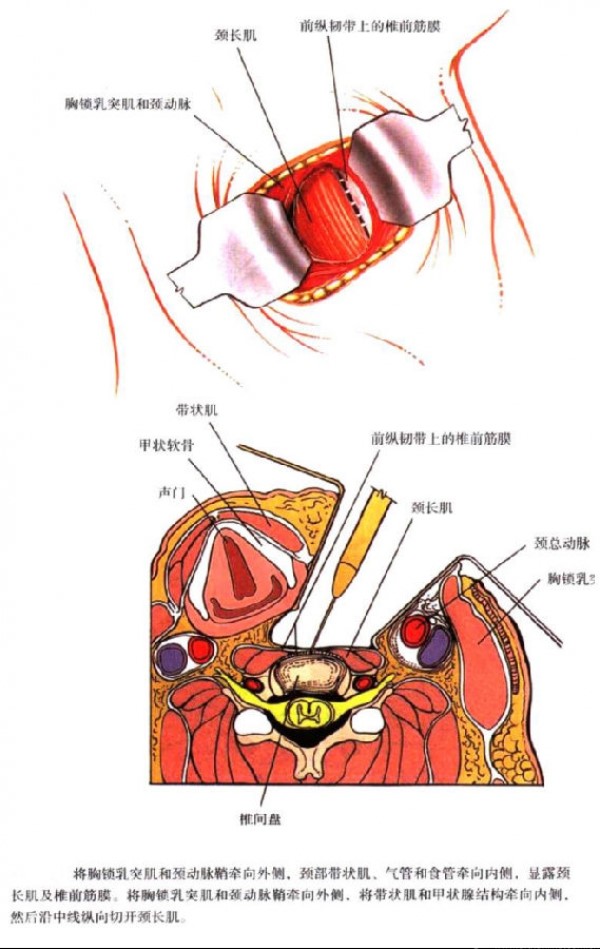
颈椎前路手术入路自1958年首次被Smith和Robinson报道以来,目前是治疗各类颈椎疾患(创伤、退行性变、肿瘤等)最常用的手术方式,而吞咽困难是颈椎前路术后最常见的并发症之一。
吞咽困难的定义是吞咽过程中出现的不适症状,包括功能性的和器质性的,指食物从口腔进入胃的过程中转运的速度和/或安全性出现异常,表现为不能吞咽或进食固体、液体食物时出现不适感。
Bazaz吞咽困难评分为目前最常用的用来评价颈前路术后吞咽困难的量表。笔者查阅了70余篇有效文献,大多数报道其发生率在1.7-79%[1-10]之间,有部分文献报道患者可能发生长期术后吞咽困难,持续时间超过半年、一年、两年,甚至更长时间。
面对如此之高的发生率,目前仍没有有效的措施对其进行治疗,因此预防其发生成为脊柱外科医生临床工作中的重要内容。
文献报道,术前气管推移锻炼、使用新型牵引器、减少气管内袖带压力、避免手术时间延长,避免常规应用rhBMP-2(重组人骨形成蛋白2)、使用低切迹钢板及零切迹自稳型颈椎融合器(zero-p)、术中前应用糖皮质激素、戒烟、安慰患者等可以有效预防颈前路术后吞咽困难的发生。

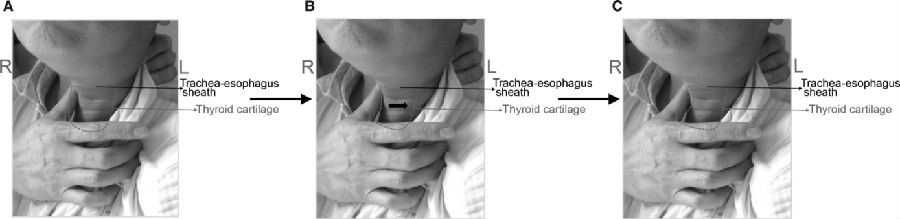
1.术前气管推移锻炼
Chen等[17]对102例行颈前路手术的患者进行前瞻性研究,其中52例接受术前气管推移锻炼。具体操作方法为:医生找到患者甲状软骨后轻轻按摩其周围软组织,从右向左轻缓地推移甲状软骨过中线至少1cm。从术前4天开始锻炼3天,每日两次,每次15下。另外50例作为对照组。
对于2-4个节段手术的患者,术后1周和术后3周的结果都显示,接受术前气管推移锻炼组的Bazas吞咽困难评分明显优于对照组。这可能是术前气管推移锻炼模拟了手术过程中的牵拉,提高了气管和食管的顺应性,从而预防术后吞咽困难的发生,尤其适用于多节段融合手术的患者。
但是,目前只有这一篇文献报道了术前气管推移训练可以预防颈前路术后吞咽困难的发生,未来还需要进一步研究证实其作用。
2.使用新型牵引器以及减少气管内袖带压力
Pattavilakom等[30]对26个接受单节段或者两个节段颈椎前路手术的患者进行随机对照前瞻性研究,比较新型的Seek牵引器(SRS)和传统的Cloward-style牵引器(CRS)术后吞咽困难的发生。
结果显示,两组并发症发生率无明显统计学差异,但是牵引器平均压力SRS组(1.9mmHg)小于CRS组(5.6mmHg)。Seek牵引器可以减少牵引器压力,从而减少对食管机械压迫,以及减少缺血发生,从而预防术后吞咽困难。
Ratnaraj等[18]对50例行颈椎前路手术的患者进行前瞻性研究,控制组27位患者放置颈部牵引器后调整气管内袖带压力恒定在20mmHg,对照组23位患者不做调整。通过监测与控制气管内袖带压力,分析术后吞咽困难的发生与气管插管内压力的关系。
结果显示,颈部牵引器增加气管内袖带压力导致术后吞咽困难发生率增加(P<0.05)。该研究建议将气管内袖带压力维持在20mmHg预防术后吞咽困难。这可能是放置颈部牵引器后气管内袖带压力增加,机械性压迫造成气管粘膜缺血,从而导致术后吞咽困难的发生,而减小气管内压力可以减少机械性压迫造成的气管粘膜缺血,从而预防术后吞咽困难的发生。
尽管多数文献报道减少气管内袖带压力可以预防术后吞咽困难发生,也有部分文献持反对意见。Arts等[20]拟定了一项单中心双盲随机对照研究计划,该研究准备纳入177位行单或多节段颈椎前路手术的患者。所有患者将会被随机分成两组,对照组放置颈椎牵引器后气管内袖带压力不做调整,干预组放置颈椎牵引器后调节气管内袖带压力恒定在20mmHg。
术后应用Bazaz吞咽困难评分来评估术后24小时和2个月吞咽困难发生情况,此项研究结果将会提供I类研究证据证实减少气管内袖带压力能否降低术后吞咽困难发生率,目前此研究结果仍未发表。
3.避免手术时间延长
Rhin等[7]以56位行腰椎后路减压的患者为对照,对38例行单节段或者两个节段颈前路手术的患者进行前瞻性研究,发现手术时间的延长是术后12周后吞咽困难严重程度的独立危险因素。
手术时间延长对术后吞咽困难的影响,可能是因为对食道的牵拉时间延长导致。Kalb等 [11]对249位行颈椎前路手术的患者进行回顾性研究发现,术后发生吞咽困难的患者平均手术时间(186分钟)大于未发生术后吞咽困难的患者(平均169分钟)。
4.避免常规应用rhBMP-2(重组人骨形成蛋白2)
Cole等[22]在MarketScan数据库中搜索了2006-2010年接受颈椎前路手术的91543位患者进行回顾性研究,其中3197位患者术中应用rhBMP、多元logistic回归分析和倾向性分析。
结果显示,应用rhBMP增加术后所有并发症的风险(OR=1.34,95%CI=1.2-1.5),其中包括吞咽困难的风险(OR=1.3,95%CI=1.1-1.5),同时应用rhBMP对患者平均增加了5545美金的花费(P<0.001)。
Jain [23]等在Nationwide inpatient sample数据库搜索了2003-2010年接受颈椎手术的1064372患者,其中84726位患者术中应用rhBMP,多元logistic回归分析显示应用rhBMP与术后吞咽困难密切相关(OR=1.53)。
Lovasik等[24]对191位行颈椎前路手术的患者进行回顾性研究,比较应用rhBMP-2和β-磷酸三钙在术后融合率和吞咽困难的差异。结果显示:rhBMP-2比β-磷酸三钙在术后6个月(70%VS26%,P=0.000),术后12个月(99%VS85%,P=0.000)融合率都高,rhBMP-2与β-磷酸三钙术后吞咽困难发生率没有明显差别(20%VS17%,P=0.5),但是应用rhBMP-2比β-磷酸三钙吞咽困难症状更严重。
rhBMP-2可能加重术后软组织肿胀,从而导致术后吞咽困难的发生,因此避免rhBMP-2的应用可以预防颈椎前路术后吞咽困难的发生。除非翻修手术或者有假关节形成高危因素的患者,因为此类患者应用rhBMP-2可以促进骨融合。
对这些必须应用rhBMP-2的患者,karles等[12]进行了随机双盲对照试验提供I类研究证据表明,每一个节段应用1*3cm的胶原海绵,内置40mg甲强龙可预防应用小剂量rhBMP-2后的吞咽困难。
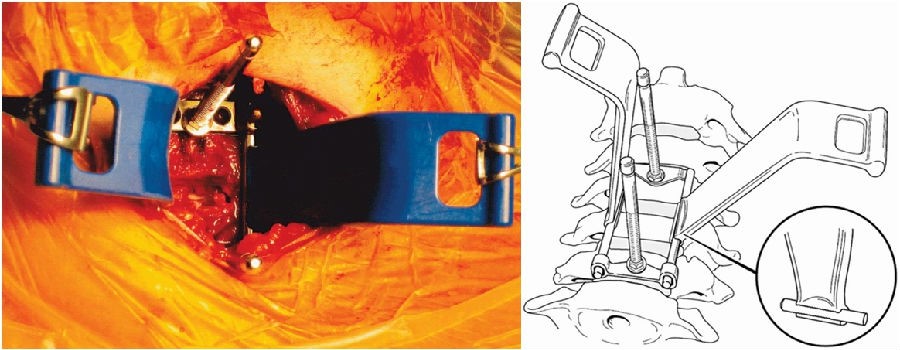
5.使用低切迹钢板及零切迹自稳型颈椎融合器(zero-p)
Lee等[28]对156位行颈椎前路手术的患者进行前瞻性研究,一组应用相对宽而厚的Altantis钢板,一组应用相对窄而薄的Zephir钢板。
结果显示,除了术后2个月的随访,其他术后任何一次随访都发现,使用Altantis钢板比Zephir钢板发生吞咽困难的几率都高,可能宽而厚的钢板会使前方食管的运动受限更大,从而导致吞咽困难发生得越多。理论上,钢板越窄而薄,其对软组织的损伤就越小,对食管的压迫作用也越小。

Liu等[25]对60位行颈椎前路手术的多节段脊髓型颈椎病患者进行回顾性研究,其中28位患者应用零切迹自稳型颈椎融合器,32位患者应用钛笼钢板。结果显示,术后3个月和末次随访吞咽困难发生率,零切迹自稳型颈椎融合器组都小于钛笼钢板组(术后3个月P=0.020,末次随访P=0.037)。
Xiao等[27]也对零切迹自稳型颈椎融合器和传统前路钛笼钢板术后吞咽困难发生率进行了系统回顾和荟萃分析,最后纳入2008-2016年16项研究,共1066位患者。结果显示,术后即刻、术后2周、术后2月、3月、6月、12月,应用零切迹自稳型颈椎融合器比传统钛笼钢板术后吞咽困难发生率都低。
这可能是应用零切迹自稳型颈椎融合器可以减少食道损伤、出血和血肿形成,以及融合器周围瘢痕形成等,可预防术后吞咽困难的发生。
6.术中前应用糖皮质激素
Siasios等[32]对颈椎前路术中应用地塞米松进行了系统回顾,共纳入5篇2000年到2015年的文章,均为前瞻性随机对照研究,其中一篇为双盲研究。
Jeyamonhan等对112位行多节段颈椎前路手术的患者进行了前瞻性随机双盲对照试验,控制组用地塞米松静脉注射。
Lee等对50位行单或双节段的颈椎前路手术的患者进行前瞻性随机对照试验,控制组为地塞米松局部应用。
Nam等对62位行单节段颈椎前路手术的患者行前瞻性随机对照试验,控制组用地塞米松静脉注射。
Pedram等对236位行颈椎前路手术的患者行前瞻性随机对照试验,控制组为甲强龙静脉注射。
Song等对40位行3个及以上节段颈椎前路手术的患者行前瞻性随机对照试验,控制组为甲强龙静脉注射。
Jeyamonhan等、Lee等、Pedram等、Song等4篇研究结果认为,应用糖皮质激素可以减少术后吞咽苦难的发生;Nam等1篇研究认为,应用糖皮质激素对减少术后吞咽困难没有作用。
大多数研究都认为,术中应用糖皮质激素可以预防术后吞咽困难的发生,可能是糖皮质激素的抗炎作用减少炎症反应,从而预防术后吞咽困难的发生。
7.戒烟
Olsson等[16]对100位行颈椎前路手术的患者进行横断面研究发现,吸烟为术后长期吞咽困难的危险因素(P=0.02),而且吸烟者的术后吞咽困难更严重。
Siska等[14]研究也发现,吸烟与颈前路术后3周吞咽困难明显相关(P=0.002)。戒烟者与从未吸烟者术后吞咽困难的发生率无明显差异。
吸烟造成颈前路术后吞咽困难的机理目前尚不明确,可能与吸烟者慢性咽炎发生率高、术后炎症反应更重有关,需要进一步研究证实。戒烟者与从未吸烟者术后吞咽困难的发生率无明显差异间接说明,戒烟可以预防术后吞咽困难的发生。

8.安慰患者
Kang等[15]对72位行单节段颈椎前路手术的患者进行前瞻性研究,比较无或轻度吞咽困难组与中重度吞咽困难组,在术前及术后1年根据NDI、NPDS、MCS、PCS评分来研究,结果显示精神因素是颈椎前路术后慢性吞咽困难的重要危险因素(P=0.005)。
因此,调节患者精神因素、安慰患者、打消患者焦虑情绪、关爱患者、使患者获得良好的住院体验等,均有助于预防术后吞咽困难的发生。

参考文献:
1. Yang, Y., et al., A Meta-Analysis of the Incidence of Patient-Reported Dysphagia After Anterior Cervical Decompression and Fusion with the Zero-Profile Implant System. Dysphagia, 2016. 31(2): p. 134-45.
2. Joaquim, A.F., et al., Dysphagia after anterior cervical spine surgery: a systematic review of potential preventative measures. Spine J, 2014. 14(9): p. 2246-60.
3. Anderson, K.K. and P.M. Arnold, Oropharyngeal Dysphagia after anterior cervical spine surgery: a review. Global Spine J, 2013. 3(4): p. 273-86.
4. Zeng, J.H., Z.M. Zhong, and J.T. Chen, Early dysphagia complicating anterior cervical spine surgery: incidence and risk factors. Arch Orthop Trauma Surg, 2013. 133(8): p. 1067-71.
5. Danto, J., et al., Multiple cervical levels: increased risk of dysphagia and dysphonia during anterior cervical discectomy. J Neurosurg Anesthesiol, 2012. 24(4): p. 350-5.
6. Cho, S.K., Y. Lu, and D.H. Lee, Dysphagia following anterior cervical spinal surgery: a systematic review. Bone Joint J, 2013. 95-b(7): p. 868-73.
7. Rihn, J.A., et al., What is the incidence and severity of dysphagia after anterior cervical surgery? Clin Orthop Relat Res, 2011. 469(3): p. 658-65.
8. Riley, L.H., 3rd, et al., Postoperative dysphagia in anterior cervical spine surgery. Spine (Phila Pa 1976), 2010. 35(9 Suppl): p. S76-85.
9. Kasimatis, G.B., et al., Complications of anterior surgery in cervical spine trauma: an overview. Clin Neurol Neurosurg, 2009. 111(1): p. 18-27.
10. Singh, K., et al., Incidence and risk factors for dysphagia after anterior cervical fusion. Spine (Phila Pa 1976), 2013. 38(21): p. 1820-5.
11. Kalb, S., et al., Dysphagia after anterior cervical spine surgery: incidence and risk factors. World Neurosurg, 2012. 77(1): p. 183-7.
12. karles,et al., Can Dysphagia Following Anterior Cervical Fusions With rhBMP-2 Be Reduced With Local Depomedrol Application?: A Prospective, Randomized, Placebo-Controlled, Double-Blind Trial, Spine (Phila Pa 1976). 2016 Apr;41(7):555-62.
13. Chen, C.J., et al., Dysphagia following combined anterior-posterior cervical spine surgeries. J Neurosurg Spine, 2013. 19(3): p. 279-87.
14. Siska, P.A., et al., Dysphagia after anterior cervical spine surgery: a prospective study using the swallowing-quality of life questionnaire and analysis of patient comorbidities. Spine (Phila Pa 1976), 2011. 36(17): p. 1387-91.
15. Kang, S.S., et al., The association between psychiatric factors and the development of chronic
dysphagia after anterior cervical spine surgery. Eur Spine J, 2014. 23(8): p. 1694-8.
16. Olsson, E.C., M. Jobson, and M.R. Lim, Risk factors for persistent dysphagia after anterior cervical spine surgery. Orthopedics, 2015. 38(4): p. e319-23.
17. Chen, Z., et al., Tracheal traction exercise reduces the occurrence of postoperative dysphagia after anterior cervical spine surgery. Spine (Phila Pa 1976), 2012. 37(15): p. 1292-6.
18. Ratnaraj, J., et al., Effects of decreasing endotracheal tube cuff pressures during neck retraction for anterior cervical spine surgery. J Neurosurg, 2002. 97(2 Suppl): p. 176-9.
19. Kowalczyk, I., et al., Reduced Endotracheal Tube Cuff Pressure to Assess Dysphagia After Anterior Cervical Spine Surgery. J Spinal Disord Tech, 2015. 28(10): p. E552-8.
20. Arts, M.P., et al., Maintaining endotracheal tube cuff pressure at 20 mm Hg to prevent dysphagia after anterior cervical spine surgery; protocol of a double-blind randomised controlled trial. BMC Musculoskelet Disord, 2013. 14: p. 280.
21. Burkus, J.K., et al., Clinical and Radiographic Outcomes in Patients Undergoing Single-level Anterior Cervical Arthrodesis: A Prospective Trial Comparing Allograft to a Reduced Dose of rhBMP-2. Clin Spine Surg, 2016.
22. Cole, T., et al., Usage of recombinant human bone morphogenetic protein in cervical spine procedures: analysis of the MarketScan longitudinal database. J Bone Joint Surg Am, 2014. 96(17): p. 1409-16.
23. Jain, A., et al., rhBMP use in cervical spine surgery: associated factors and in-hospital complications. J Bone Joint Surg Am, 2014. 96(8): p. 617-23.
24. Lovasik, B.P., et al., Anterior Cervical Discectomy and Fusion: Comparison of Fusion, Dysphagia, and Complication Rates between Recombinant Human Bone Morphogenetic Protein-2 and Beta-Tricalcium Phosphate. World Neurosurg, 2016.
25. Liu, Y., et al., Comparison of a zero-profile anchored spacer (ROI-C) and the polyetheretherketone (PEEK) cages with an anterior plate in anterior cervical discectomy and fusion for multilevel cervical spondylotic myelopathy. Eur Spine J, 2016. 25(6): p. 1881-90.
26. Yin, M., et al., The new Zero-P implant can effectively reduce the risk of postoperative dysphagia and complications compared with the traditional anterior cage and plate: a systematic review and meta-analysis. BMC Musculoskelet Disord, 2016. 17(1): p. 430.
27. Xiao, S., et al., Zero-profile anchored cage reduces risk of postoperative dysphagia compared with cage with plate fixation after anterior cervical discectomy and fusion. Eur Spine J, 2016.
28. Lee, M.J., et al., Influence of anterior cervical plate design on Dysphagia: a 2-year prospective longitudinal follow-up study. J Spinal Disord Tech, 2005. 18(5): p. 406-9.
29. Jang, J.W., J.H. Park, and S.C. Rhim, Does plate profile affect postoperative dysphagia following anterior cervical spine surgery? J Clin Neurosci, 2014. 21(1): p. 78-81.
30. Pattavilakom, A. and K.A. Seex, Results of a prospective randomized study comparing a novel retractor with a Caspar retractor in anterior cervical surgery. Neurosurgery, 2011. 69(2 Suppl Operative): p. ons156-60; discussion ons160.
31. Jeyamohan, S.B., et al., Effect of steroid use in anterior cervical discectomy and fusion: a randomized controlled trial. J Neurosurg Spine, 2015. 23(2): p. 137-43.
32. Siasios, I., et al., The role of steroid administration in the management of dysphagia in anterior cervical procedures. Neurosurg Rev, 2016.
文章来源:首都医科大学附属北京朝阳医院骨科