黄韧带骨化(OLF)是脊柱韧带异位骨化性疾病的一种,是韧带内纤维组织转化为骨性组织的过程。该病最早于1912年由LeDouble首先发现并报道。Polgar在1920年最先在文献中描述了OLF的X线影像学表现。OLF在颈椎、胸椎、腰椎均可发生,以胸椎特别是下胸椎(T9~T12)最为常见,年龄分布多见于40~60岁。胸椎黄韧带骨化(TOLF)是引起胸椎管狭窄的主要原因,起病隐匿,临床上压迫脊髓神经可引起感觉运动障碍及二便功能障碍,手术是唯一有效的治疗手段。TOLF往往临床症状重,若不及时手术减压解除压迫挽救神经功能,预后较差。迄今为止TOLF发病机制尚不清楚,其诊断和治疗均是临床上不易解决的问题。本文对该病基础和临床研究的进展作一综述。
病因与发病机制
力学因素 临床及基础研究证实,应力在TOLF的发生发展过程中起着至关重要的作用。OLF好发的下胸椎和胸腰段是脊柱从相对固定的胸段向活动度较大的腰段过渡的区域,该区域的黄韧带可能受到较大的牵张应力的影响;OLF好发于胸腰段也可能与局部关节突关节的解剖结合方向有关,这些小关节的运动方式增加了局部旋转不稳定及微量移动。此外,动物实验表明局部的反复应力可以导致脊柱韧带内软骨形成。临床上也发现存在节段不稳的脊柱韧带骨化的患者中骨化往往发展迅速,Kaneyama等研究了无系统疾病和家族病史的年轻棒球运动员中OLF的发生情况,认为反复的局部旋转机械应力可能是导致OLF发生的重要原因。细胞学研究也发现牵张应力对黄韧带细胞成骨具有促进作用。
Fan证实牵张应力可以诱导黄韧带细胞向成骨方向分化,其中转录因子osterix是感受应力刺激并调节成骨分化的关键因子,在TOLF进程中起着关键作用。Cai等发现培养的OLF细胞中β-链蛋白(β-catenin)、骨桥蛋白、Runt相关转录因子2(Runx2)和转录因子Sox9的mRNA表达水平显著高于非OLF细胞,在施加了24h周期性牵张应力后,OLF细胞中β-catenin、Runx2、Sox9和骨桥蛋白的表达均明显升高,且呈现一定的时间依赖性,该研究初步证实了牵张应力和β-catenin信号在调控OLF细胞向软骨分化中的协同作用,认为应力可通过β-catenin信号通路促进软骨细胞分化,进一步促进软骨内骨化形成。
遗传因素及种族差异 TOLF主要发生在东亚黄种人,尤其高发于日本、中国等国家,少见于欧美白色人种与非洲地区。这一明显的种族地域差异现象表明,易感基因可能在TOLF发病过程中起着关键作用。Kong等发现中国汉族人群染色体21q22.3上COL6A1启动子区的单核苷酸构象多态性与TOLF发病关系密切。其他目前报道的与TOLF有关的易感基因还包括Runx2、骨形态发生蛋白(BMP)4及主要组织相容性复合体DQα1(HLA-DQA1)等。
分子生物学因素 许多细胞因子在OLF发病过程中起重要作用,其中包括BMP、软骨源性形态发生蛋白1(也称生长分化因子5,GDF-5)及转化生长因子-β(TGF-β)等。BMP-2是目前唯一能独立诱导异位骨化的蛋白因子,它可以诱导黄韧带内的纤维母细胞分化为软骨细胞。Hou等将重组人骨形态发生蛋白2(rh-BMP-2)装载于Ⅰ型胶原后,置于大鼠胸腰段黄韧带局部硬膜外间隙,分别在第1、3、9周行黄韧带中骨化病灶形成的组织学检查,发现rh-BMP-2诱导的OLF为典型的软骨内成骨,类似于临床OLF的病理特征,在第1周时韧带椎板的附着处发现少量异位骨化,第3周时韧带腹侧结构被骨组织代替,第9周可见韧带完全骨化。Zhong等发现GDF-5可通过活化ERK1/2和p38MAPK信号通路诱导黄韧带细胞成骨分化,GDF-5可促进碱性磷酸酶及骨钙素的表达,且该作用具有时间和剂量依赖性。
此外,一些转录因子和炎性细胞因子在OLF的发病过程中也起到了重要作用。Uchida等发现OLF的骨化过程与转录因子特殊表达所致的软骨细胞分化有关,OLF韧带细胞中Sox9、Runx2、肌节同源盒基因2(Msx2)和激活蛋白1(AP-1)的表达水平与非OLF组存在显著差异。Ren等研究认为炎症因子白细胞介素(IL)-6和肿瘤坏死因子(TNF)-α在OLF的发病中起到了至关重要的作用。Park等通过体外实验发现炎性细胞因子IL-6、前列腺素E2(PGE2)、TNF-α及NO在黄韧带肥厚骨化中发挥重要作用,在炎性因子处理的黄韧带细胞中,Ⅰ、Ⅴ、Ⅺ型胶原蛋白和骨钙素的DNA合成以及mRNA表达显著增加,代表骨结节形成的VonKossa染色也呈现阳性。
其他因素 文献报道退变因素、内分泌代谢、饮食习惯等也与TOLF的发病有关。患有肥胖症、糖尿病、强直性脊柱炎、氟骨症、钙磷代谢异常等代谢性疾病者更易发生OLF。
影像学表现及分型
胸椎侧位X线片是检查TOLF的基本初筛手段,TOLF多表现为椎间孔处钩状或鸟嘴样的占位。可以根据形态分为棘状型、鸟嘴型、结节型和线样型等,发生率分别为65.5%、17.7%、8.4%和8.4%。但是X线检查也具有一些局限性,其中包括肩部及肝脏对上胸椎和胸腰段的遮挡影响以及早期的骨化在平片上很难辨认等。
目前CT和MRI在TOLF的影像学诊断中起重要作用,两者可分别在轴位和矢状位显示TOLF的形态、位置、骨化情况及神经压迫情况。其中CT能更好地反映骨化程度,而MRI则能更好地反映脊髓神经受压情况,两者联合有利于TOLF的诊断。TOLF的CT形态学分类有多种,其中常用的Sato分型最为经典,TOLF在横断面上分为侧方(lateral)、延伸(extended)、扩大(enlarged)、融合(fused)和结节(tuberous)五型,其中前三型可归为非融合型,后两型可归为融合型。另外也有学者分为三型:单侧(unilateral)、双侧(bilateral)和融合型(bridged)。CT分型目前常被用于评估TOLF手术的预后情况。
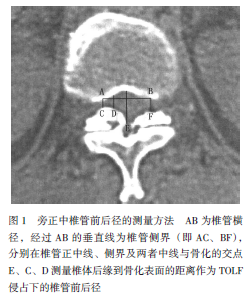
但其只是形态上的分型,各型TOLF对椎管侵占的程度并没有量化。北京大学第三医院在TOLF的病例对照研究中根据CT影像测量椎管矢状径、椎管发育性矢状径、椎管面积、椎管发育性面积,计算出椎管矢状径残余率、椎管面积残余率,认为TOLF椎管侵占程度与神经损害程度有关,CT椎管面积残余率<80%可作为TOLF引发脊髓损害的影像学标准。Feng等进一步在手术治疗TOLF研究中发现,CT横断面椎管前后径残余率(旁正中)与术前JOA评分是影响手术疗效的重要因素,旁正中椎管前后径残余率<60%时诊断TOLF引发脊髓损害的灵敏度为95.5%、特异度为95.5%(图1)。另外,在MRI横断面可将TOLF分为四度。Ⅰ度:黄韧带存在骨化,硬膜囊尚未受压或刚接触。Ⅱ度:硬膜囊受压变形,脊髓未受压。Ⅲ度:硬膜囊受压致局部闭塞,骨化韧带已接触脊髓表面,脊髓未明显受压变形。Ⅳ度:脊髓受压致明显变形。也有报道在矢状位MRI上将TOLF分为圆隆(round)型和鸟嘴(beak)型。
此外,根据TOLF在影像学上的分布特点,陈仲强等将其分为局灶型、跳跃型和连续型骨化。在一项针对中国南方人群无症状志愿者的全脊柱MRI检查中,Guo等发现TOLF发病率为3.8%(66/1736),其中单节段TOLF占68.2%,而≥2个节段者占31.8%(其中11例为连续型,10例为跳跃型)。
Lang等报道在对993例因胸部症状就诊患者行CT检查时发现TOLF发生率为63.9%,其中29.3%的TOLF为单节段,而70.7%为多节段,但在多节段患者中,大部分(86.1%)为节段连续的双节段患者。而陈仲强等在随访到的82例TOLF术后患者中发现,局灶型占11.0%、连续型占53.6%、跳跃型占35.4%。Li等报道在40例手术治疗的TOLF患者中,局限型(两节段以内)占25%,连续型(>2节段)占60%,同时非连续型占15%。结合目前的资料,TOLF中单节段或双节段在总体人群中的发病率更高,但是进展至手术的患者中似乎多节段更多。
临床表现
TOLF早期未压迫脊髓或神经时无明显症状,不易被发现;早期压迫也仅表现为以下肢无力、发僵为特征的间歇性跛行或并发腰腿疼痛。典型的TOLF表现为胸髓受压引起的下肢上运动神经元损害的症状和体征。但是位于下胸椎或胸腰段的TOLF由于对脊髓腰膨大或圆锥造成压迫,可能表现为下运动神经元损害或混合型损害。总之,TOLF临床表现复杂多样,临床上需仔细甄别并结合影像学检查才能作出正确诊断。
治疗
手术治疗 手术减压是目前TOLF唯一有效的治疗方法,对仅压迫硬脊膜囊而无脊髓损害表现者,可暂给予密切观察。对TOLF压迫脊髓产生症状或体征者应积极行减压手术。手术基本采用后路减压,报道的术式有全椎板切除、椎板开窗、半椎板切除、椎管扩大成形术及椎间孔切开术等。目前已基本达成共识,后路减压范围包括椎板及关节突内侧半,即“椎管后壁”,临床上大多采用北京大学第三医院早期提出的“揭盖式”整块切除,该术式效果好,而且关节突内外缘中线正对硬膜囊外缘,操作安全。其他报道的减压技术包括“漂浮法”和“根黄通道法”等,也有学者使用导航及内镜技术分别进行了初步探索。王岩等使用超声骨刀在TOLF等胸椎管狭窄症的减压手术中取得了良好的效果,认为超声骨刀增加了手术的安全性和有效性。
临床资料显示TOLF患者合并脊髓型颈椎病(CSM)或颈椎后纵韧带骨化(OPLL)的比例高达37.5%~48.8%,孙垂国等通过计算JOA脊髓功能评分得到上肢功能评分构成比,认为其>36%有合并胸椎管狭窄症的可能,若>43%则肯定合并;进一步研究认为上胸椎OLF合并CSM者应一期行颈椎和上胸椎脊髓减压术,下肢症状严重而上肢症状轻微者应先行胸脊髓减压术,上、下肢症状均重者应一期或分期行颈脊髓减压术和胸脊髓减压术,而分期手术者的手术间隔时间不宜过长。TOLF也常合并发生胸椎OPLL或胸椎间盘突出(TDH)。
Hou等报道的309例TOLF患者中有41.4%合并OPLL或TDH。当脊髓前后均受压迫需充分减压时,传统的手术方案是采取前后联合入路,其创伤及神经损伤风险均较大。Tomita最早提出了环形减压术,陈仲强改进了脊髓环形减压术,术中切除双侧关节突后沿椎体侧面行骨膜下剥离,从椎体的后外侧切除椎间盘或骨化的后纵韧带,这样既可以避免对脊髓的牵拉损伤,又可以解决上胸椎前路手术因纵隔影响而存在的较大风险。
疗效评价 既往多项研究证实胸椎管后壁切除减压术是治疗TOLF安全有效的手术方式,在相关的多项手术疗效研究中未发现有显著影响的因素包括性别、年龄、骨化分型、体质量指数、吸烟史、饮酒史、糖尿病、矢状位分型(圆隆型和鸟嘴型)、CT横断面分型、是否内固定以及有无合并其他脊柱疾患等。回顾文献,针对其他可能影响手术疗效因素的研究也有不同结果。有研究认为术前病程是显著因素,有的则认为只是有影响趋势而无统计学意义。另外,术前神经功能情况与手术疗效关系的报道结果也不尽相同。但最新的一些研究表明,术前病程及术前神经功能评分对手术疗效的影响差异具有统计学意义。
此外,一些临床资料显示多节段TOLF的预后与单节段明显不同。Gao等研究发现累及多节段(≥5)的TOLF手术疗效明显差,且具有统计学意义。Kawaguchi等报道TOLF受累节段多时术后恢复情况虽然没有统计学意义,但是呈现出较差的趋势。另外,一些5年以内的随访研究均显示病变节段位于中胸椎的TOLF手术后疗效更差,但孙垂国等在对44例TOLF患者平均8.5年的随访研究中发现,减压节段累及T10~L2节段者远期疗效较限于T1~T9范围内患者差,认为这与手术部位缺乏胸廓支撑及局部继发节段不稳定有关。
另外,Ando等在一项多中心研究中发现硬膜骨化也会明显导致手术疗效差。但最近其他一些研究均未发现TOLF合并硬膜骨化会导致手术疗效差。Li等也发现TOLF患者在MRI上发生髓内信号改变时将导致术后疗效较差。但近来另一些研究则认为髓内信号改变与术后疗效无关。除上述因素外,Kawaguchi等报道大拇趾关节处位置感受损是影响TOLF术后疗效的重要因素。另外也有研究显示连续型的前纵韧带骨化是术后疗效差的危险因素。
并发症 TOLF常见的手术并发症包括脊髓或神经根损伤、硬脊膜损伤及脑脊液漏、硬膜外血肿形成、术后脊柱失稳甚至后凸畸形等。其中以硬脊膜损伤合并脑脊液漏最为常见,其发生的主要原因是严重骨化致硬脊膜受压,继而发生硬脊膜粘连甚至骨化。Sun等在对266例TOLF患者的研究中发现硬脊膜损伤合并脑脊液漏的发生率为32%,硬膜骨化发生率为25.3%。术中及时细致的硬脊膜修补可减少脑脊液漏的发生,术后脑脊液漏患者经俯卧位及持续引流后95.5%可一期痊愈,少数需要穿刺及清创缝合。TOLF最严重的并发症是术后截瘫,可能与术中脊髓损伤或术后血肿有关。
总之,TOLF的发病机制尚不清楚,可能由多种因素综合造成。该病临床表现复杂,容易漏诊、误诊,故应密切结合患者临床表现及影像学检查来诊断和治疗。目前通用术式为椎体后壁切除减压,合并脊髓腹侧压迫时可行经关节突椎管环形减压术,应依据患者病变具体情况选择适宜的手术方案,将基础与临床研究有机结合,进一步阐明TOLF的发病机制,并且努力寻找和完善更加准确有效的诊断及治疗手段,以使该病得到有效的预防,并获得更好的治疗效果。
来源:中国矫形外科杂志2017年6月第25卷第11期